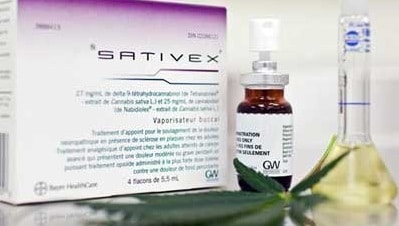
Le Sativex est unique en son genre dans le sens où il est le premier médicament pharmaceutique fabriqué à partir de la plante entière de cannabis. Il contient de vrais cannabinoïdes (molécules actives du cannabis) et non des éléments de synthèse.
Si d’autres médicaments comparables au Sativex existent et qu’il s’assimile parfois aux teintures ou huiles de cannabis, il peut être pertinent de se poser les questions suivantes :
-
-
- En quoi se distingue t-il des autres médicaments contenant des cannabinoïdes?
- Peut-il se comparer au cannabis médical ?
- Est-il légal en France en 2021 ?
- Où peut on s’en procurer ?
- Est-il remboursé par la sécurité sociale ?
- Quel est son prix, son mode d’action ?
-
Ce médicament pose de vraies questions légitimes puisque la stigmatisation du cannabis comme drogue est toujours d’actualité au même moment où la « grande industrie pharmaceutique » met en lumière les réelles capacités de cette plante à soulager des patients. Notamment, avec la multiplication des CBD shops. L’usage du Sativex apparaît alors comme une étape importante pour l’avancée du cannabis médical en Europe et dans le monde.
Sativex, un médicament à part
Le Sativex (ou nabiximols) a été créé par GW Pharmaceuticals en 1998. A l’heure actuelle, il est disponible dans pas moins de 30 pays.
Il s’obtient à partir de la plante entière de chanvre. Plus particulièrement, il est un concentré de deux cannabinoïdes propres au cannabis :
-
- le THC ou tétrahydrocannabinol
- le CBD ou cannabidiol
Ce concentré de cannabis au ratio proche de 1:1 (THC:CBD) se consomme sous forme de spray buccal.
Son utilisation est recommandée dès lors que les traitements de références administrés aux patients atteints de spasticité modérée ou sévère due à une sclérose en plaque (SEP) ne soulagent pas suffisamment.
On note en effet, une efficacité de ce traitement aux cannabinoïdes chez environ 10% de patients insuffisamment soulagés par un traitement antispastique référentiel.
Le spray Sativex, composition, concentration et utilisation
Composition et concentration
Comme il a été dit plus haut, le spray Sativex fabriqué par l’entreprise britannique GW Pharmaceuticals contient un ratio 1:1 de THC et de CBD. Ces 2 cannabinoïdes originellement présents dans le chanvre représentent les 2 principaux principes actifs de ce médicament si particulier. Un tel équilibre est cependant difficile à atteindre puisque naturellement le cannabis contient une teneur en THC bien supérieure à celle du CBD.
Chaque vaporisation (100 µL) de ce spray contient :
- 2,7 mg de tétrahydrocannabinol (THC)
- 2,5 mg de cannabidiol (CBD)
- Parmi les ingrédients non médicinaux, on retrouve: de l’éthanol, du propylèneglycol et de l’essence de menthe poivrée.
Utilisation et posologie
Le spray Sativex se vaporise directement dans la bouche, en sublingual ou à l’intérieur de la joue.
La posologie de ce médicament est fonction de la condition médicale du patient et de sa sensibilité à ce traitement. On parle de bonne dose lorsque un soulagement effectif est atteint sans effets secondaires importants.
Pour la majorité des sujets, 4 à 8 doses quotidiennes sont suffisantes. Cependant, pour un adulte novice au traitement, la posologie générale est :
- une vaporisation 2 fois par jour, le premier jour. Les effets sont censés être ressentis après 30 minutes.
- A partir du 2e jour, il peut être pertinent de faire 1 pulvérisation supplémentaire toutes les 24 heures. En revanche, il ne faut pas dépasser 12 vaporisations par jour. De plus, il faut espacer ces pulvérisations par un intervalle de temps régulier.
Autorisation de mise sur le marché, prix et remboursement du Sativex en France
Le 8 janvier 2014, le Sativex obtient son autorisation de mise sur le marché (AMM) en France. Ce médicament doit être prescrit par un médecin neurologue et un rééducateur hospitalier. Et ce, uniquement pour certains patients atteints de sclérose en plaques dans le but de soulager les contractures sévères (spasticité), résistantes aux autres traitements habituels. C’est au laboratoire Almirall qui se voit confier la commercialisation française de ce médicament.
Ce médicament se vend déjà dans de nombreux pays européens (Pays-Bas, Espagne, Italie, Allemagne, …), au Canada, en Australie et dans de nombreux Etats américains. Mais, en France, malgré son AMM obtenue en 2014, la vente du Sativex sur le sol français connaît encore un blocage. En effet, l’entreprise Almirall, le Comité économique des produits de santé (CEPS) et le laboratoire GW Pharmaceuticals, fabricant du Sativex, n’arrivent pas à se mettre d’accord dans leurs négociations :
- Almirall propose de vendre le Sativex 350 euros la boîte
- Le CEPS qui est l’organisme interministériel fixant les prix des médicaments et les tarifs des dispositifs médicaux pris en charge par l’assurance maladie obligatoire offre un tarif n’excédant pas 90 euros.
- Le laboratoire GW Pharmaceuticals a, lui, fait un effort en baissant ses tarifs à 320 euros (au lieu de 440e en moyenne en Europe)
Malgré un avis favorable en octobre 2014 de la Haute Autorité de Santé (HAS) pour octroyer un remboursement à 15 % de ce traitement, en 2016, une nouvelle demande de commercialisation reste sans suite à cause du Comité CESP qui bloque toujours.
Peut-on acheter du Sativex dans une pharmacie en France ?
Comme dit plus haut, le Sativex est un produit ayant son AMM sur le territoire français. Cependant, à cause de blocages tarifaires, il ne se retrouve toujours pas dans nos pharmacies.
Son prix et le fait que ce produit contienne du THC et du CBD naturels le différencie des autres « cannabinoïdes » pharmaceutiques tels que le Marinol. Pour ne citer que lui!
Mais, le décret du 9 octobre 2020 publié dans le journal officiel (1) laisse présager une avancée cruciale en faveur du cannabis thérapeutique. Et, de ce fait, un pas vers la commercialisation du Sativex en pharmacie. Ce décret autorise un usage expérimental du cannabis médical sur 3000 patients sur une durée de 2 ans. L’objectif étant d’évaluer, dans des conditions réelles, les recommandations de la commission de santé, de sécurité et des conditions de travail (CSST) :
- médicaments à base de fleurs séchées de chanvre et d’extraits à spectre complet ( huile fullspectum)
- produits à effet immédiat (sublinguales et inhalées à base d’huile et de fleurs séchées pour vaporisation)
- formes à effet prolongé (produits oraux sous forme de solution buvable ou de capsules d’huile de chanvre).
Le 26 mars 2021, la France a commencé cette expérimentation du cannabis thérapeutique. Elle porte sur 3 000 patients souffrant de maladies graves telles que :
- l’épilepsie, les douleurs neuropathiques, la sclérose en plaques…
Le 9 juin 2021, L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) annonce la mise en place d’un nouveau comité scientifique temporaire. Il se compose de 13 membres responsables du suivi de cette expérimentation et ce, afin :
- d’observer le bon déroulement de cette expérimentation
- de pouvoir proposer des ajustements de posologie et mise en œuvre.
Le cannabis médical se prescrit et se vend déjà dans de nombreux pays européens et dans le monde. Le Sativex, lui, a déjà obtenu son AMM en France. On peut espérer que cette expérimentation du cannabis thérapeutique viendra alors définitivement débloquer la situation administrative et financière des traitements aux cannabinoïdes. Notamment, ceux naturellement présents dans la plante de chanvre. Et, répondra positivement aux standards pharmaceutiques français.
Le Sativex, le Marinol et l’Epidiolex, des médicaments qui font parler d’eux
Actuellement, il existe 3 médicaments à base de cannabinoïdes ayant reçu une autorisation d’utilisation temporaire par l’ANSM ou une AMM. Chacun d’eux possède un lien avec le cannabis et seul un médecin peut les prescrire. En revanche, ils se distinguent dans leur composition et, de ce fait dans leur usage :
-
- Le Sativex : médicament aux concentrations en molécules de CBD et THC équivalentes. Produit particulièrement intéressant pour les formes modérées ou sévères de spasticité des patients atteints de sclérose en plaque. Il n’est pas commercialisé au grand dam de des malades car son prix est jugé trop élevé à ce jour.
- Le Marinol considéré comme un antalgique, un anti vomitif et un excellent allié pour les personnes atteintes de maladies engendrant une forte baisse de l’appétit. Son principe actif est le dronabinol qui est un cannabinoïde de synthèse mimant l’activité du THC.
-
- L’Epidiolex est le premier médicament issu du cannabis et destiné à certaines épilepsies (syndrome de Dravet et syndrome de Lennox-Gastaut). Comme le Sativex il se compose de vrais cannabinoïdes mais en revanche, lui, ne contient pas de THC. Son composé actif est le cannabidiol (CBD).
Pour conclure sur le Sativex, ce médicament au cannabis
Par sa composition (THC et CBD) le Sativex est très proche des teintures de cannabis, des sprays sublinguaux et des huiles de chanvre fullspectrum qu’on trouve dans les dispensaires des pays ouverts au cannabis médical. Comme le cannabis médical qui répond à des standards pharmaceutiques, il est prescrit par des médecins et délivré par des pharmaciens. En revanche, il se distingue fortement par son mode de fabrication qui se restreint à l’entreprise pharmaceutique britannique GW Pharmaceuticals.
FAQ : CBD et Sativex
[sp_easyaccordion id=”9740″]
Références
1 Décret du Journal officiel du 9 octobre 2020 : https://www.legifrance.gouv.fr/download/pdf?id=zyKaQMl-O9XMuCnn2OUL_lbzpqBy_eO97Xv1twZ4Wyg=